今天为您介绍的是——城市污水管网的规律
城市污水管网是一个收集、 运输城市污水的系统,是城市水利基建的重要组成部分[1]. 然而,污水在管网内的运输过程中水质发生了变化,生化需氧量(BOD)、 化学需氧量(COD)会有不同程度的变化[2~6],溶解性有机碳(DOC)也存在着降低的现象[7~9]. 同时,在污水运输过程中,还发现管网的管壁上有生物膜的形成[10~12],由此人们开始关注污水管网中微生物对水质的改变作用.
在城市污水管网中,由于污水中含有挥发性脂肪酸(VFA)等物质,为产甲烷过程提供了物质基础[13~15]. 先前研究发现,在管网中,确实有CH4的产生[16~18]. 管网中CH4的产生对管网的运行管理和污水处理带来极大的隐患. CH4是一种温室气体,管网中的CH4排放到空气当中会加剧温室效应[19, 20]; 当管网内CH4浓度超过5%时有爆炸的危险[21, 22]; 管网内CH4的产生会带走一部分COD,这不利于后续污水处理厂的生物脱氮除磷的过程[23, 24],因此管网中CH4的产生是值得关注的问题. CH4的产生与管网中的产甲烷菌有关,因此研究管网中的产甲烷菌也具有重要意义. 然而,目前对管网内产甲烷菌的演替规律了解甚少.
基于此,本文通过建立一套1 200 m管道系统,对污水管网内CH4沿程变化及产甲烷菌的分布特性进行研究,并探明了产甲烷菌可利用基质与产甲烷菌分布之间的关系.
1 材料与方法
1.1 实验条件和原水水质
反应器为城市污水模拟管网反应器[25],以西安市城市污水作为原水,在室温下运行,实验温度为(25±2)℃,pH为7.2±0.3,密封性良好. 管网沿程的溶解氧(DO)为(0.3±0.05)mg ·L-1,沿程变化不大,总体变化趋势为沿程降低,且由于管网始端和末端暴露在空气中,溶解氧相对含量较高,溶解氧沿程变化如图 1所示.
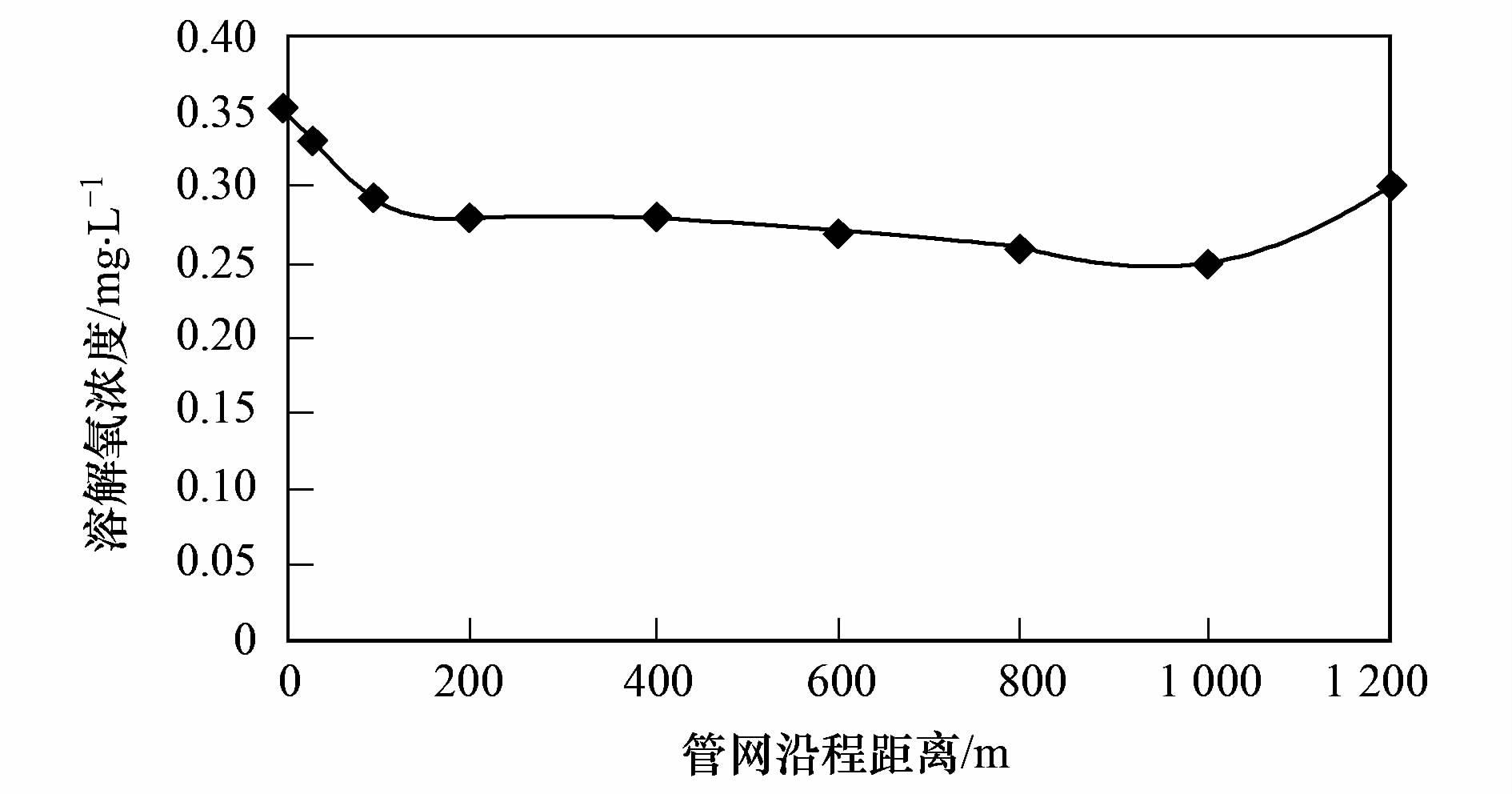
图 1 管网沿程中溶解氧的变化
在反应器连续运行期间,通过控制管网坡度为5‰和污水充满度0.6,来使污水流速为0.6m ·s-1,水力停留时间为1h. 污水依靠重力进入模拟管段. 在反应器连续运行期间,原水的水质状况如表 1所示.
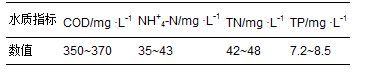
表 1 城市污水管网中的水质特性
1.2 取样方法
在800 m的管网系统中选取8个取样点,其中选取原水作为0 m处的取样点,然后一次在分别选取30、 100、 200、 400、 600、 800、 1 000和1 200 m处作为剩余的8个取样点进行水质分析,分析指标包括COD、 氨氮(NH+4-N)、 总氮(TN)、 总磷(TP)等常规指标及发酵产物. 对于生物分析所需要的生物膜样品采集,以30、 100、 200、 400、 600、 800、 1 000和1 200 m作为生物膜取样点. 首先将8个位置的管段两端的活结松开,取下管段,将管段里的有机玻璃条取出,用无菌棉签将适量的生物膜从有机玻璃载体上刮入一次性培养皿中并将培养皿盖好,然后立即放入装有干冰的保温盒并送至实验室-20℃保存.
1.3 分析方法
1.3.1 乙酸分析
水样分析之前用3%的磷酸将水样的pH调节到4左右,再将水样用0.45 μm滤膜过滤. 分析仪器为GC-2014气相色谱仪(日本岛津). 氢火焰离子化检测器,色谱柱为DB-FFAP(30 m×0.5 μm×0.32 mm). 升温程序: 初始柱温100℃保持2 min,以10℃ ·min-1的速度升至120℃保持2 min,再以6℃ ·min-1升至200℃保持2 min. 进样口温度200℃,检测器温度230℃,进样量1 μL. N2作为载气和补偿气,速率均为20mL ·min-1. H2速率为35mL ·min-1,空气为350mL ·min-1.
1.3.2 甲醇分析
测定甲醇和乙醇的浓度选用方法为气相色谱法,进样方式为顶空进样. 分析仪器为GC-2014气相色谱仪(日本岛津),色谱柱为CB-5(30 m×0.5 μm×0.32 mm),FID检测器,并配有AOC-5000顶空自动进样器. 升温程序: 50℃保持5 min,以5℃ ·min-1的速度升至100℃,保持2 min,以5℃ ·min-1的升温速度升至200℃. 进样口温度为200℃,检测器温度为280℃; 载气流量为5.0mL ·min-1; 分流比2 ∶1. 顶空自动进样器条件: 加热平衡温度为80℃,加热平衡时间30 min; 取样针温度为90℃; 进样体积1.0 mL.
1.3.3 甲酸分析
分析仪器选用LC2010AHT液相色谱仪(日本岛津),色谱柱为Hypersil BDS C18(250 mm×4.6 mm×5 μm),紫外检测器,波长设置为210 nm. 流动相为0.02mol ·L-1 KH2PO4 ∶甲醇(体积比为95 ∶5),用磷酸调节pH到2. 流速设置为1.0mL ·min-1,柱温30℃,进样体积10 μL.
1.3.4 甲胺分析
甲胺浓度采用液相色谱法进行测定. 上机测样之前对样品进行PITC衍生化处理,并用C18柱进行固相萃取. 分析仪器选用LC2010AHT液相色谱仪(日本岛津),色谱柱为Hypersil BDS C18(250 mm×4.6 mm×5 μm),紫外检测器,波长设置为240 nm. 流动相为乙腈 ∶水(体积比为30 ∶70),流速设置为1.0mL ·min-1,柱温30℃,进样体积10 μL.
1.3.5 CH4分析
CH4的测定选用气相色谱法,分析仪器为GC-2014气相色谱仪(日本岛津). 检测器为热导检测器(TCD),色谱柱型号为TDX-01填充柱. 柱温设置为100℃,保持10 min. N2作为尾气,流速为10.0mL ·min-1. Ar作为载气,流速为48mL ·min-1. 使用标准气体混合气校准,其组分为37% CO2、 4% N2、 0.802% H2以及CH4.
1.3.6 其他水质分析
实验中COD、 NH+4-N、 TN和TP的测定采用国家标准方法.
1.3.7 DNA提取和PCR扩增
采用Power Soil DNA提取试剂盒(MO Biomedical,U.S.)对生物膜样本中的DNA进行提取,提取方法按照试剂盒制造商提供的方法使用说明书进行. 对于产甲烷菌基因片段的扩增,选用特异性引物MLf 5′- GGTGGTGTMGGATTCACACARTA YGCWACAGC-3′和MLr 5′- TTCATTGCRTAGTTW GGRTAGTT- 3′[26]. PCR反应体系(20 μL): 5×FastPfu Buffer 4 μL,dNTPs 2 μL,引物各0.8 μL,FastPfu聚合酶0.4 μL,模板DNA 10 ng,加无菌水至20 μL. PCR条件: 95℃预变性2 min,95℃变性30 s,55℃退火30 s,72℃延伸30 s,25个循环,比较后72℃延伸5 min. 2%琼脂糖凝胶电泳检测PCR产物.
1.3.8 产甲烷菌454高通量测序
用AeyPrepDNA凝胶回收试剂盒切胶回收PCR产物,Tris-HCl洗脱,并用2%琼脂糖电泳检测. 参照电泳初步定量结果,将PCR产物用QuantiFluorTM-ST蓝色荧光定量系统(Promega公司)进行检测定量,之后按照每个样本的测序要求,进行相应比例的混合. 用Roche GS FLX Titanium emPCR试剂盒对混合物进行emPCR扩增,扩增后的混合物按照454平台的标准方法,在Roche 454 GS FLX+Titanium平台上进行上机测序.
2 结果与分析
2.1 管网系统中CH4气体的产生
图 2中展现了管网中CH4的含量的变化趋势,结果表明CH4含量较低均在3%以下,远小于50%,所以管网内甲烷化程度较低[27]. 从中可以看出,CH4在管网中的变化规律是沿程增加的. 在0~30 m处,没有CH4的产生,这可能由于在管网始端,污水中溶解氧含量较高,不适合产甲烷菌富集生长,此外污水中的有机物质以大分子有机物为主,这些大分子有机物质无法被产甲烷菌直接利用. 随着管网沿程距离的不断增加,管道内CH4的含量也不断升高,在1 200 m处达到比较大值,其含量为2.75%. CH4含量沿程升高,这是由于管道内的水解发酵过程使得大分子物质转化为VFA(乙酸)等小分子物质,产甲烷菌得以不断利用乙酸等可利用基质,使得CH4在管网中不断产生并得到积累,故管网中的CH4含量随之升高.

图 2 管网沿程中CH4含量的变化
2.2 管网系统中产甲烷菌的沿程分布特性 2.2.1 管网系统中产甲烷菌的构成及多样性分布
表 2反映了管网中产甲烷菌的构成及其相对丰度情况,从中可以看出,管网中检测到的产甲烷菌共有9种,其中甲烷八叠球菌属、 广古菌门中的菌属、 甲烷杆菌科中的菌属和古菌门中的菌属在管网中始终存在.

表 2 管网中产甲烷菌的构成1)/%
图 3展现了管网沿程产甲烷菌的多样性变化. Shannon指数是表征物种多样性的指标[28],因此在图 3中是通过Shannon指数来反映产甲烷菌的多样性变化. 由于在管网初始端30 m处的生物膜样本中没有生成有效序列,即在30 m处没有检测到产甲烷菌,故30 m处不存在产甲烷菌,这可以很好地解释图 2中30 m处没有CH4的生成. 从中可以看出,100~600 m之间Shannon指数沿程降低,由100 m处的2.7降低至600 m处的1.58,600~800 m处的Shannon指数保持稳定,说明管网800 m之前产甲烷菌的多样性沿程降低,且在600~800 m之间保持稳定; 在管网1 000 m处,Shannon指数突然升高,此后一直保持稳定,Shannon指数稳定在2.2左右,说明管网末端多样性较为丰富且保持稳定.

图 3 产甲烷菌多样性在管网中的沿程变化
2.2.2 管网系统中产甲烷菌菌群结构分析
图 4所示的是产甲烷菌的热图分析,是在属水平下进行的分析,不同的颜色代表了不同的相对丰度值,蓝色相对丰度比较低,红色相对丰度比较高,图顶的分支表示了样本之间的结构相似性. 由于30 m没有产甲烷菌,因此管网30 m处的样本不参与热图分析. 图 4中聚类结果表明,管网100~1 200 m中的产甲烷菌群落结构共分为两大类,其中200~800 m为一类,100、 1 000和1 200 m为一类. 200~800 m这一类中,600 m和800 m中的群落结构比较为相近,而在100、 1 000和1 200 m的这一类中,以1 000 m和1 200 m的群落结构比较为相似; 在800 m和1 000 m这一相邻位置处,群落结构发生了明显的改变,说明在该处存在着产甲烷菌的演替现象. 同时,根据图中的颜色分布可以看出,在管网中的优势菌群有甲烷八叠球菌属、 广古菌门中的菌属和甲烷杆菌科中的菌属,其中甲烷八叠球菌属和广古菌门中的菌属为主要优势菌群.
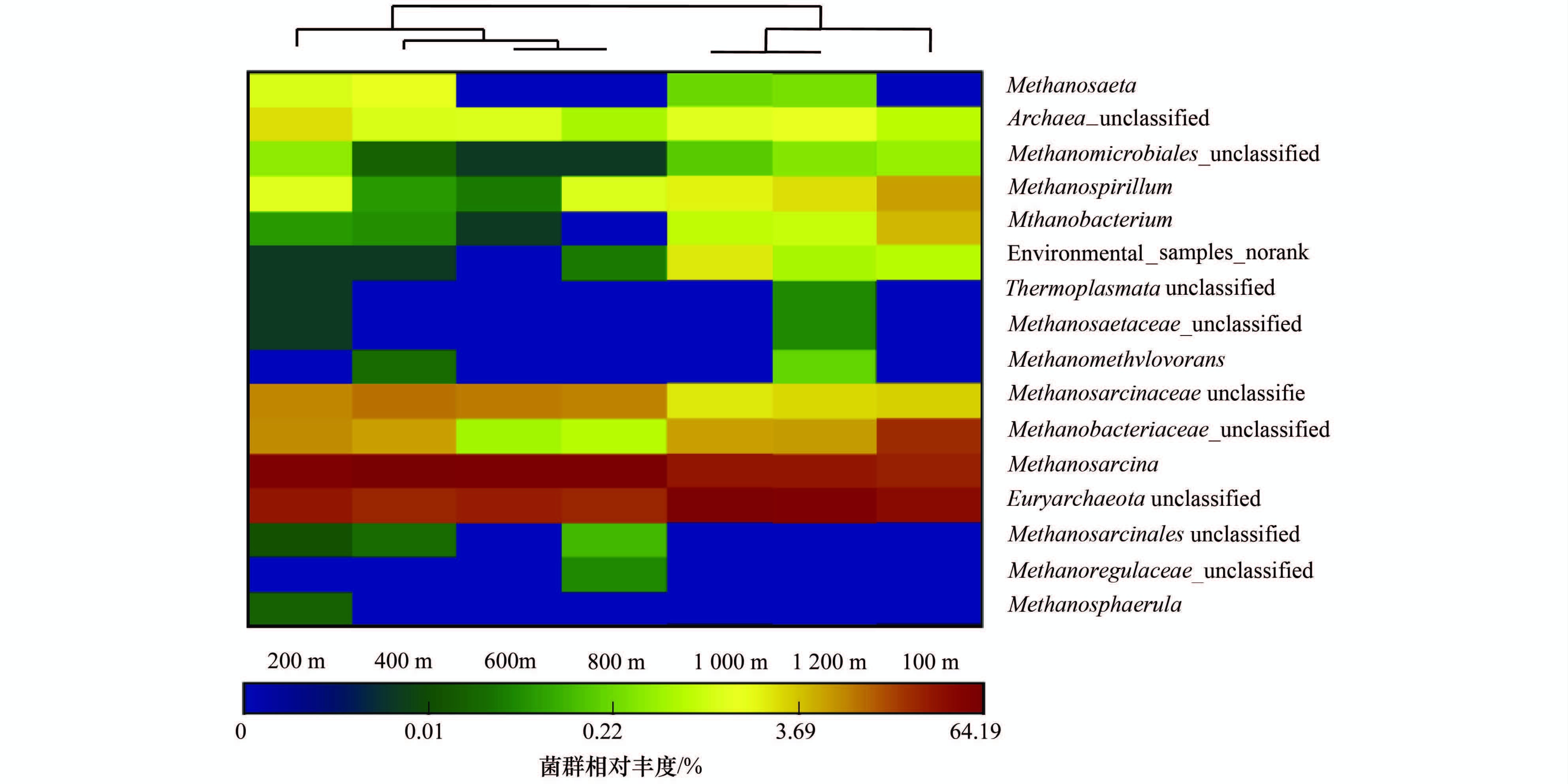
图 4 产甲烷菌聚类(热图)分析
2.2.3 产甲烷菌的菌属演替过程
优势菌群是一个群落中的主要构成部分,基于1.2.2节的结果对管网中的优势产甲烷菌进行进一步的分析. 图 5反映了管网中优势产甲烷菌相对丰度的沿程变化,结果表明,甲烷八叠球菌属、 广古菌门中的菌属和甲烷杆菌科中的菌属,这3种产甲烷菌相对丰度变化规律较为明显. 在管网30 m处,3种菌属都不存在,在管网100~800 m范围内,甲烷八叠球菌属的相对丰度在3种优势菌属中比较高,且随着管网距离的增加相对丰度也不断增加,与之相反,广古菌门中的菌属和甲烷杆菌科中的菌属在管网100~800 m的范围内相对丰度的沿程变化趋势与甲烷八叠球菌属严格相反,它们的相对丰度在管网中沿程降低,其中甲烷杆菌科中的菌属在600~800 m之间失去优势地位,相对丰度均在0.7%以下; 在管网1 000~1 200 m范围内,甲烷八叠球菌属的相对丰度降低并保持稳定,广古菌门中的菌属和甲烷杆菌科中的菌属相对丰度升高并保持稳定,其中广古菌门中的菌属)超过甲烷八叠球菌属成为3种菌属中相对丰度比较高的菌属. 从图 5中可以看出,600 m和800 m、 1 000 m和1 200 m的优势菌属的相对丰度变化不大,这与图 4中的群落结构分析可以很好地对应起来,也说明了群落中的优势菌属的构成基本反映了群落结构的构成情况. 同时,在800~1 000 m的过程中,3种产甲烷菌的相对丰度、 优势地位和变化趋势都发生了改变,说明在该管网范围内,产甲烷菌群中菌属发生了演替过程,即在该处广古菌门中的菌属取代了甲烷八叠球菌属成为优势菌属.
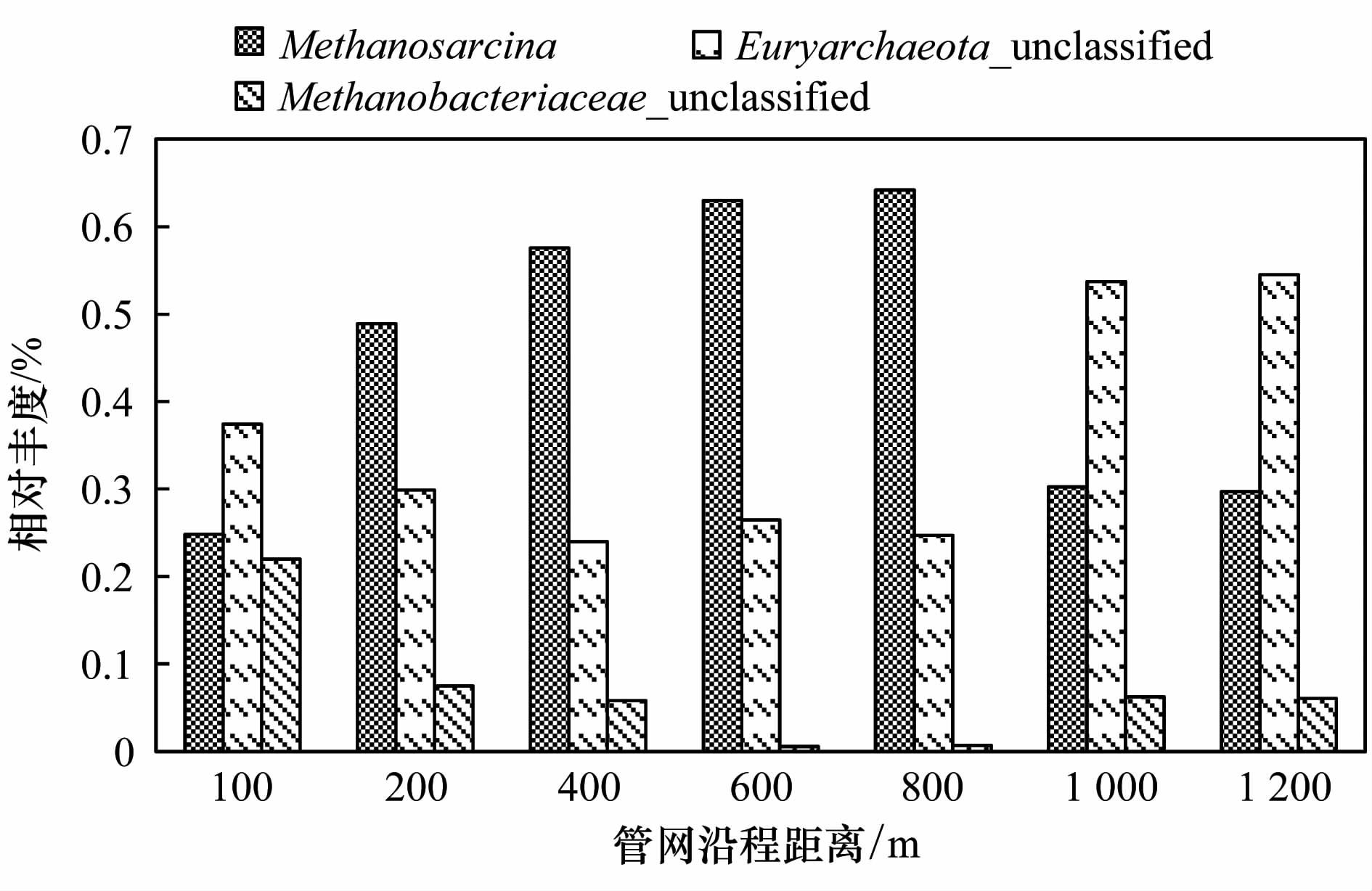
图 5 优势产甲烷菌相对丰度在管网中的沿程变化
2.3 产甲烷菌可利用基质的变化规律
图 6反映了产甲烷菌可利用基质的变化情况. 管道中存在的产甲烷菌可利用基质有甲酸、 甲醇、 甲胺、 乙酸(“三甲一乙”)和H2,其中乙酸的含量比较高,而甲胺的含量极低. 由于H2是气相产物且在管网中的含量很低,本文对H2不做过多论述. “三甲一乙”这4种基质在管网中的变化规律基本一致,均呈现出先增加后降低的变化趋势.

图 6 管网中产甲烷菌可以用基质的沿程变化
乙酸在整个管网中含量比较高,在管网0~600 m沿程增加并在600 m处达到比较大值8.67mg ·L-1,并在600~800 m处保持稳定,而后开始沿程逐渐下降; 甲酸在管网0~400 m沿程增加并在400 m处达到比较大值3.64mg ·L-1,而后开始沿程降低; 甲醇在30 m处达到比较大值2.17mg ·L-1后开始沿程降低; 而甲胺在整个管网中的含量之中保持在很低的水平且浓度不超过0.015mg ·L-1,在800 m处含量比较高0.011mg ·L-1. 这4种基质在管网中均存在含量降低的现象,说明这4种基质在管网中都被产甲烷菌利用生成CH4. 在管网中,乙酸是含量比较高的产甲烷可利用基质,即产甲烷菌可以利用的乙酸多,且根据厌氧三阶段理论,在发酵产甲烷过程中72%的CH4主要来自于乙酸[29],说明在管网中产甲烷菌主要利用乙酸. 管网中0~800 m处甲烷八叠球菌属相对丰度比较高,主要利用乙酸生成CH4[30, 31],甲烷八叠球菌属的相对丰度在该范围内沿程增加,这很好地解释了在0~800 m乙酸含量的变化情况,且600~800 m乙酸含量保持稳定,而甲烷八叠球菌属的相对丰度也保持稳定; 管网800 m处以后,乙酸含量下降,且微生物代谢过程中使得某些中间产物富集,这对甲烷八叠球菌属而言,环境开始变得恶劣,这就使得其在该环境下处于不利的地位,竞争能力下降,从而相对丰度下降,广古菌门中的菌属和甲烷杆菌科中的菌属在该环境下竞争优势增强,相对丰度增加.
3 结论
(1)城市污水管网中生成CH4的量较低,管网中甲烷化程度较低. 在管网初始端没有CH4的产生,而后随着管网距离的增加,CH4在管网中呈现出了逐渐增加的变化趋势.
(2)城市污水管网中产甲烷菌主要包含,甲烷八叠球菌属、 广古菌门中的菌属和甲烷杆菌科中的菌属这3种. 产甲烷菌的群落结构在800~1 000 m发生了明显的改变,在管网该范围内发生了广古菌门中的菌属取代甲烷八叠球菌属成为优势菌属的演替过程.
(3)城市污水管网中产甲烷菌可利用基质“三甲一乙”中乙酸含量比较高,甲胺含量始终维持在极低的水平. 这些物质在管网中均呈现出了先增加后降低的变化趋势,其中乙酸在600~800 m含量维持稳定. 由于不同产甲烷菌属适应的物质条件和环境条件不同,因此这些物质条件和环境条件的改变,使得产甲烷菌在管网中的分布发生了改变.

污水处理设备联系方式:
销售热线:010-8022-5898
手机号码:186-1009-4262





