染料废水处理方法-吸附法
1 引言(Introduction) 染料废水被认为是极难处理的污染物之一,纺织、造纸、印刷、食品和化妆品都会有染料污染物的排放.染料废水因有机物含量高、毒性大、难降解等,会导致许多疾病,如癌症、贫血和呼吸障碍等.目前,染料的处理方法有电化学法、光催化法、生物氧化法以及吸附法等.吸附法因不会引入新的污染物、能耗低而倍受关注,其中磁分离吸附法优点更加突出,在继承吸附法的优点的同时易于分离,快速去除污染物. 多巴胺是一种动物体内神经传导的递质,也是一种激素.海洋贝类的黏附蛋白的主要成分就是多巴胺.在弱碱性溶液条件下,多巴胺暴露在空气中就会很快地自聚并被氧化成粉红色的聚合多巴胺,比较终会聚沉为带有芳香结构和儿茶酚的团体,这个过程是完全自发的,并且其可以聚合在多种基质表面.聚合多巴胺(PDA)具有良好的亲水性、生物相容性和稳定性,可以保护载体粒子.包覆以后不仅保留了载体的性质,而且可以丰富载体性质,在许多领域得到了应用.如利用多巴胺包覆碳纳米管,并且用来沉积金纳米颗粒和用二氧化硅和多巴胺包覆在磁性纳米材料上,应用于生物分离方面.然而,PDA包覆层不稳定,容易从基质上脱附下来.如果将材料在隔绝空气的条件下高温加热,可以将PDA碳化,得到具有稳定的碳包覆层的新型吸附材料. 本研究采用聚合多巴胺包覆磁性氧化铁,然后在高温下碳化制备碳材料包覆的氧化铁(Fe3O4@C).以甲基绿为目标物,研究该材料的吸附性能. 2 实验部分(Experimental section)2.1 实验试剂 本实验所用试剂均为分析纯.FeCl3·6H2O和甲基绿购于天津市大茂化学试剂厂(中国,天津).三羟基氨基甲烷(Tris)购于成都化学试剂厂(中国,四川).乙二醇和乙醇购于烟台三和化学试剂有限公司(中国,烟台). 2.2 材料制备 Fe3O4纳米颗粒依照文献制备.取FeCl3·6H2O 2.7 g,NaAc 7.2 g,聚乙二醇2.0 g,溶于80 mL乙二醇中,搅拌至澄清,然后转移到聚四氟乙烯内衬的高压反应釜中200 ℃下反应24 h后取出,用乙醇清洗两次,蒸馏水洗3次,用磁铁分离,烘干.取200 mg Fe3O4纳米颗粒,240 mg Tris,240 mg 多巴胺,加200 mL纯水在冰水浴下混合,超声10 min后,室温搅拌24 h.反应完毕后,用纯水洗涤5次,磁分离后烘干.干燥后在管式炉中氩气保护下600 ℃灼烧4 h,在升温过程中控制升温速率为1 ℃·min-1,比较终得到Fe3O4@C.聚合多巴胺炭材料(C)的制备除在溶液中不加入Fe3O4纳米颗粒外,其它步骤与Fe3O4@C的制备类似. 2.3 材料表征 利用透射电镜(TEM,H-7500,Hitachi,Japan)和扫描电镜(SEM,SUPPATM55,Zeiss,Germany)观察制得的吸附材料的形貌和粒径,吸附材料的磁性能采用振动磁强计(VSM,LDJ9600)测得.采用傅立叶变换红外光谱仪(FT-IR NEXUS 670 Madison,WI,USA)分析表面基团.材料的晶体结构采用X射线衍射分析仪(Rigaku D/max2500 VPC,日本理学)测定.为表征炭材料的结构,采用激光共聚焦拉曼光谱仪(Lab RAM HR800,法国Horiba Jobin Yvon公司)对样品进行分析,所用激光波长为530 nm.材料的比表面积及孔隙特性采用比表面积及孔隙度分析仪(ASAP2020,美国麦克公司)测定. 2.4 吸附试验 吸附试验用100 mL聚乙烯瓶,装25 mL溶液.吸附剂的浓度为0.20 g·L-1,甲基绿浓度从20~140 mg·L-1来做等温吸附实验,选择纯水、取自校园的湖水和实验室的自来水作为介质考察不同水样的吸附容量.pH调节从3.0~10.0来研究酸度对甲基绿吸附的影响.混合悬浮液在30 ℃恒温水浴震荡,在不同间隔的时间段内取样来测定甲基绿的吸附动力学.热力学实验选择吸附温度为20、30和40 ℃.各吸附到时间后,将溶液放在磁铁上进行分离5 min,然后取上层清液用紫外分光光度计(UV-2550,Shimadzu)来测定甲基绿的浓度.各吸附实验平行进行3次,文中报道数据为3次平均值. 3 结果与讨论(Results and discussion)3.1 材料表征结果 图 1a为Fe3O4扫描电镜图,可以看到Fe3O4球形分散均匀,直径约为160~300 nm,但其表面看起来粗糙,裂缝宽.图 1b为Fe3O4@C材料,表面光滑裂缝变细致均匀,直径也增大到约为330~390 nm.透射电镜图 1c显示出Fe3O4为单分散的球形纳米颗粒,粒径均匀,约为200 nm.图 1d Fe3O4@C材料图中可以看出,内部黑色的颗粒为Fe3O4纳米颗粒,外层灰色的部分是包覆聚合多巴胺灼烧后的碳,厚约50 nm,粒径均匀,轮廓清晰.扫描电镜和透射电镜图都证明了Fe3O4被完全包覆到了碳壳层里.比表面积及孔隙度分析仪测得Fe3O4@C材料的BET比表面积为98.83 m2·g-1,孔体积为0.064 cm3·g-1,平均孔径为25.9 nm,Fe3O4@C材料上的孔隙以介孔为主,这些介孔结构使得材料具有比较高的比表面积和孔体积,有利于提高其吸附性能,从扫描电镜图上也可以清晰的观察到表面包覆的炭材料的孔隙.

图 1 Fe3O4和Fe3O4@C的扫描电镜(a,b)和透射电镜(c,d)图 图 2给出了Fe3O4、Fe3O4@C的磁滞回线.Fe3O4没有磁滞现象,矫顽磁性和剩磁基本为零,表现出顺磁性的特性,而Fe3O4@C出现了明显的磁滞现象,剩磁为7.86,矫顽力为251,显示出少量铁磁性,这可能是由于在聚合多巴胺炭化的过程中部分Fe3O4在高温条件下相变为Fe2O3.Fe3O4和Fe3O4@C的比较大饱和磁强度分别为78.7 emu·g-1和47.2 emu·g-1.Fe3O4@C磁性降低是因为引入了无磁性的壳层.材料吸附了污染物后,利用磁铁很容易从溶液中分离出来.
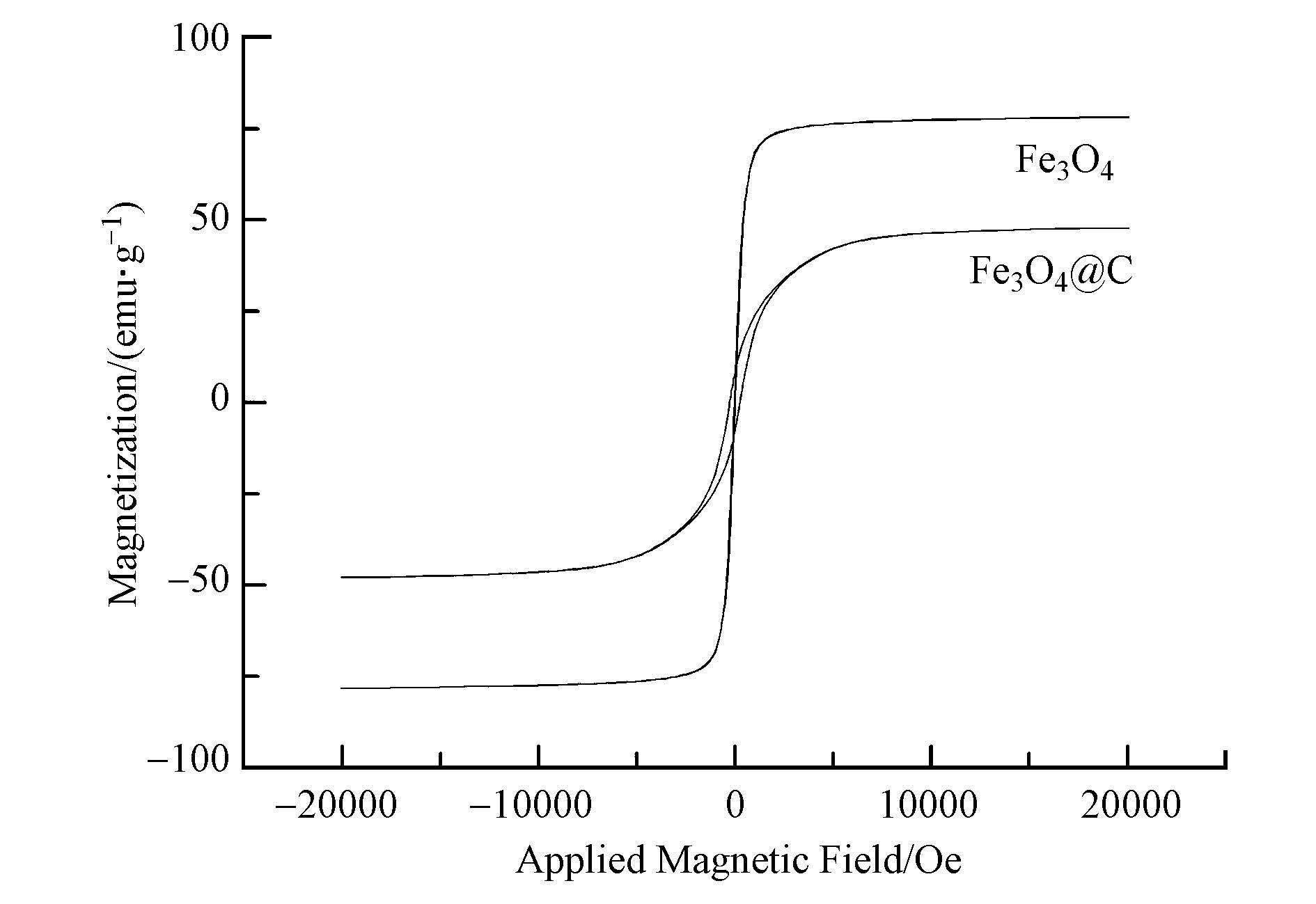
图 2材料的磁滞回线 图 3给出了Fe3O4、聚多巴胺包覆的Fe3O4@PDA、Fe3O4@C的X射线衍射图.Fe3O4和Fe3O4@PDA衍射峰的位置完全一样,在2θ为30.12°、35.38°、43.05°、53.39°、56.91°、62.54°处出现了较强的衍射峰,其分别对应立方相Fe3O4的(220)、(311)、(400)、(422)、(511)、(440)晶面(张燚等,2011;危晶等,2012;黄保军等,2012),经过在高温下炭化得到的Fe3O4@C除在以上位置有衍射峰外,在2θ为33.17°和49.33°处有较小的衍射峰,对应着斜六方Fe2O3的(104)和(024)晶面,这说明在炭化的过程中部分Fe3O4相变为Fe2O3,与磁性测量的结果一致.
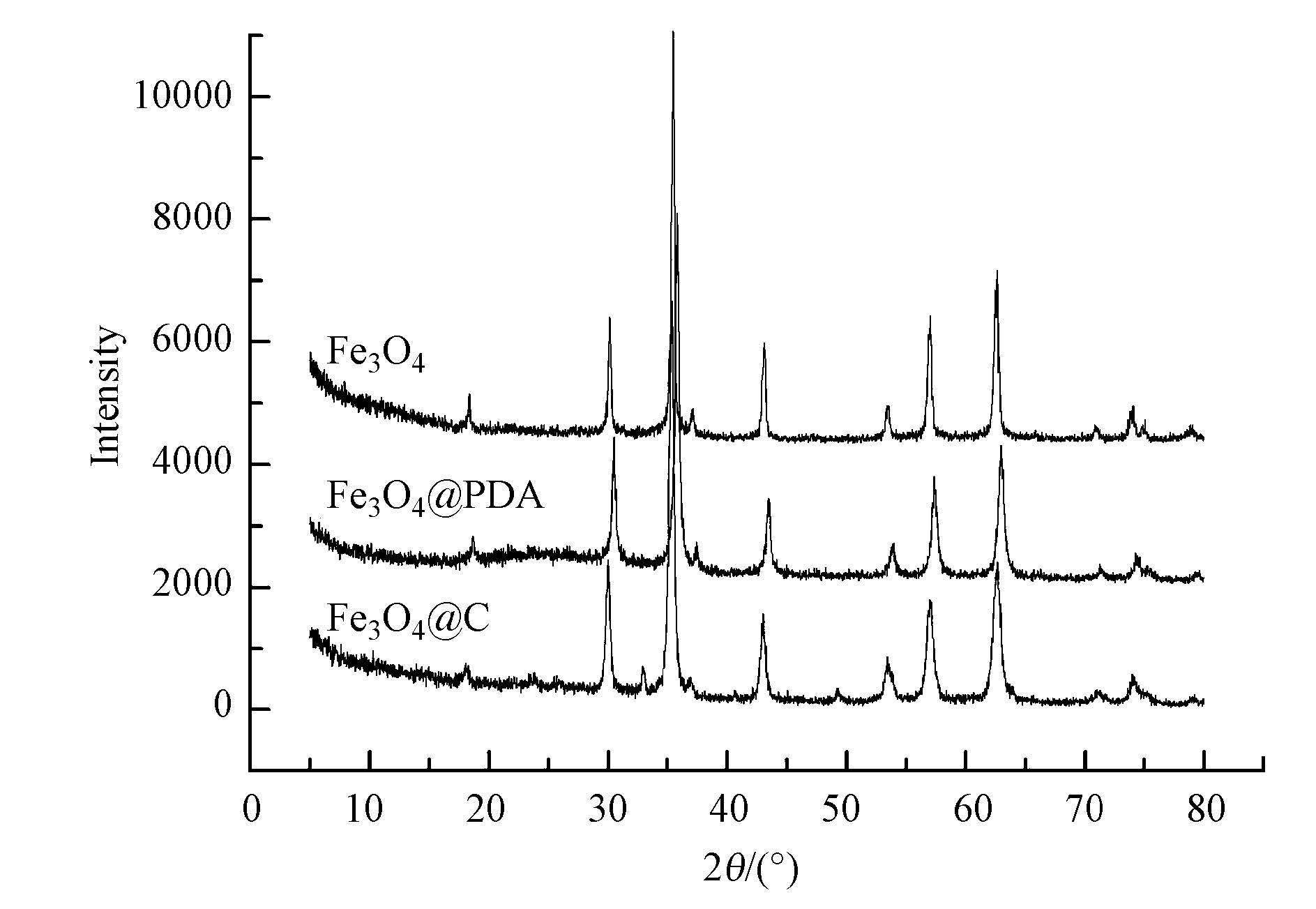
图 3材料的X射线衍射曲线

图 4 Fe3O4,Fe3O4@C和C的红外光谱图 图 4是Fe3O4、Fe3O4@C和C的红外光谱图,图中均在3440.98 cm-1和1638.86 cm-1处出现吸收峰,分别为材料表面吸附水的O—H的伸缩振动峰和弯曲振动峰(王雪等,2013),炭化后的材料在3440.98 cm-1处的峰强度明显降低,这是由于材料炭化后疏水性增强,表面吸附水减少造成的.Fe3O4和Fe3O4@C的谱图在584.89 cm-1出现的吸收峰是Fe—O的伸缩振动峰,并且包覆了C材料后,Fe—O的峰明显减小.在Fe3O4的谱图中2844.59、2926.20 cm-1出现的小峰为—CH2或—CH3的C—H的特征振动峰(Wang et al,2008),这些C—H的特征峰可能是由于溶剂热法制备Fe3O4颗粒过程中有机溶剂引入的.聚合多巴胺炭化后的材料红外谱图除去没有Fe—O的伸缩振动峰外,基本跟Fe3O4@C的谱图类似,这表明了炭材料被包覆到Fe3O4上. 图 5为Fe3O4@C的拉曼光谱图,图谱中出现在波数为1350 cm-1附近的峰称为D峰,D峰反映炭原子晶体的缺陷程度,是石墨晶格缺陷、边缘无序排列和低对称碳结构所引起的,代表炭材料中乱层结构,是无序碳对应的特征峰,其强度表征材料中sp2碳组成的六角网平面以及非石墨化边界数量,即无序化度,位于波数为1580 cm-1附近的峰为G峰,是由石墨晶体的面内振动产生,和材料的石墨化程度有关,是用来表征石墨的峰(王定美等,2013;周慧龙等,2014;李伟等,2014).D峰和G峰的出现表明炭材料成功的包覆到Fe3O4上,G峰强度强于D峰说明在高温炭化的过程中部分炭材料被石墨化.
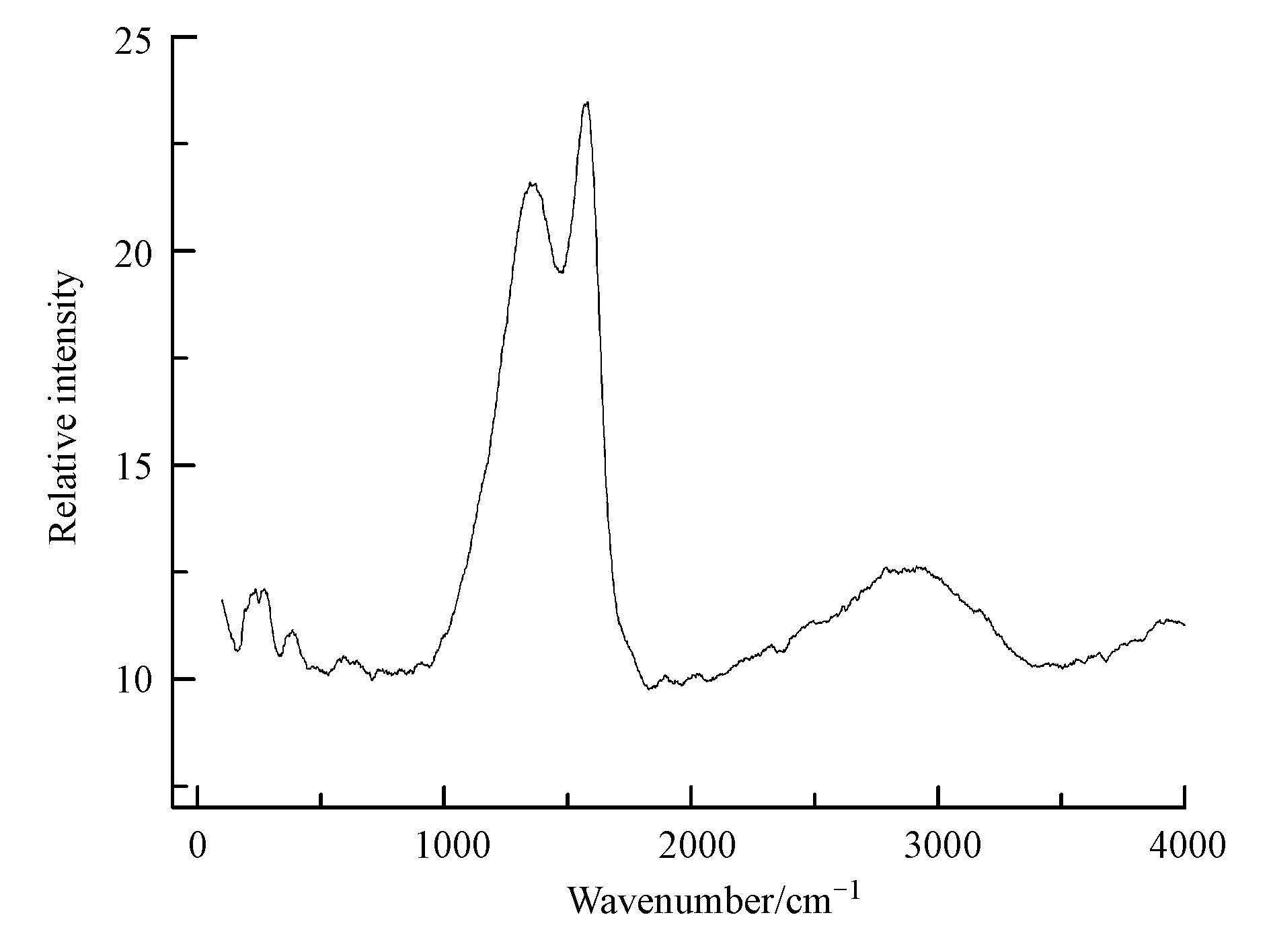
图 5 Fe3O4@C的拉曼光谱 3.2 溶液pH值对吸附的影响 溶液的pH对吸附剂的结合位点以及电离影响很大,因此研究不同pH下吸附剂对甲基绿的吸附.如图 6所示,在低pH下甲基绿的吸附量很小,随着pH增加,吸附量也增加,到pH为8的时候吸附量基本趋于不变.在低pH下,吸附剂表面质子化,带上正电荷,而甲基绿在溶液中以阳离子的形式存在,二者之间的静电斥力导致不能有效的吸附.pH增大后,Fe3O4@C表面脱质子带负电,在静电作用下,二者有利于相互接触并进一步吸附.所以Fe3O4@C对甲基绿的后续吸附实验设定在中性和弱碱性条件下进行.

图 6溶液pH对Fe3O4@C吸附甲基绿的影响 3.3 吸附等温线 等温吸附研究在30 ℃下进行,甲基绿初始浓度设置为20、40、60、80、100、120、140 mg·L-1,为考察吸附剂对不同水样中甲基绿的吸附效果,选择纯水、湖水和自来水作为介质,吸附数据如图 7a.随着各水样中甲基绿浓度的上升,吸附容量在开始时急剧上升,随后就趋于平缓,说明吸附达到了饱和.采用朗格缪尔和弗伦德里希两种模型对吸附数据进行拟合,两种模型线性方程如(1)、(2)所示.

(1)

(2) 式中,qe和Ce 分别为平衡吸附容量(mg·g-1)和平衡浓度(mg·L-1);θ为比较大吸附容量,b为平衡吸附常数.比较大吸附容量θ可以通过Ce /qe对Ce斜率的线形 图计算.KF(mL1/n μg1-1/n)和n是Freundlich常数.n和KF的值是通过logqe对logCe的线性拟合的截距求出.图 7b是吸附数据的Langmuir线性拟合.

图 7 Fe3O4@C对甲基绿的吸附等温线(a)和Langmuir线性拟合(b) 表 1是两种模型的拟合参数.对同一水样,Langmuir模型拟合的相关系数(R2)要高于Freundlich模型,吸附数据和Langmuir模型相符合,说明Fe3O4@C对甲基绿的吸附是一种单分子层吸附.使用Langmuir吸附等温线计算出Fe3O4@C对纯水、湖水和自来水中甲基绿的比较大吸附容量分别为490.1、442.5和389.1 mg·g-1.和纯水相比,湖水和自来水的吸附容量有所降低,这可能是由于其中含有的干扰离子造成的,但仍然保持了相当高的吸附容量.表 2列出了文献中报道的吸附剂对甲基绿的吸附容量,可以看出,除还原石墨烯吸附容量较高外,本研究制备的Fe3O4@C的吸附容量优于其他吸附剂,并且该吸附剂具有利用磁铁易于实现固液分离的优点,说明该吸附剂在处理染料污染物方面有较大的潜力.
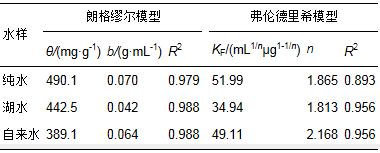
表 1 甲基绿在Fe3O4@C上吸附的Langmuir和Freundlich模型拟合参数
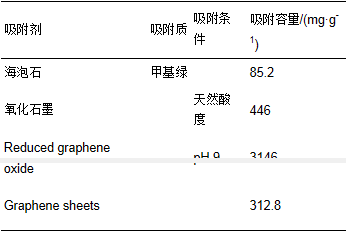
表 2 文献报道的其他吸附剂对甲基绿的吸附容量 3.4 吸附动力学 甲基绿的吸附动力学见图 8a,甲基绿的吸附量随时间的增加快速上升,到一定时间后趋于平缓,吸附时间达到200 min后,吸附容量基本不随时间延长而增加,说明已经达到吸附平衡.用拟二级动力学模型描述Fe3O4@C对甲基绿的吸附,线性方程如式(3)、(4)所示.
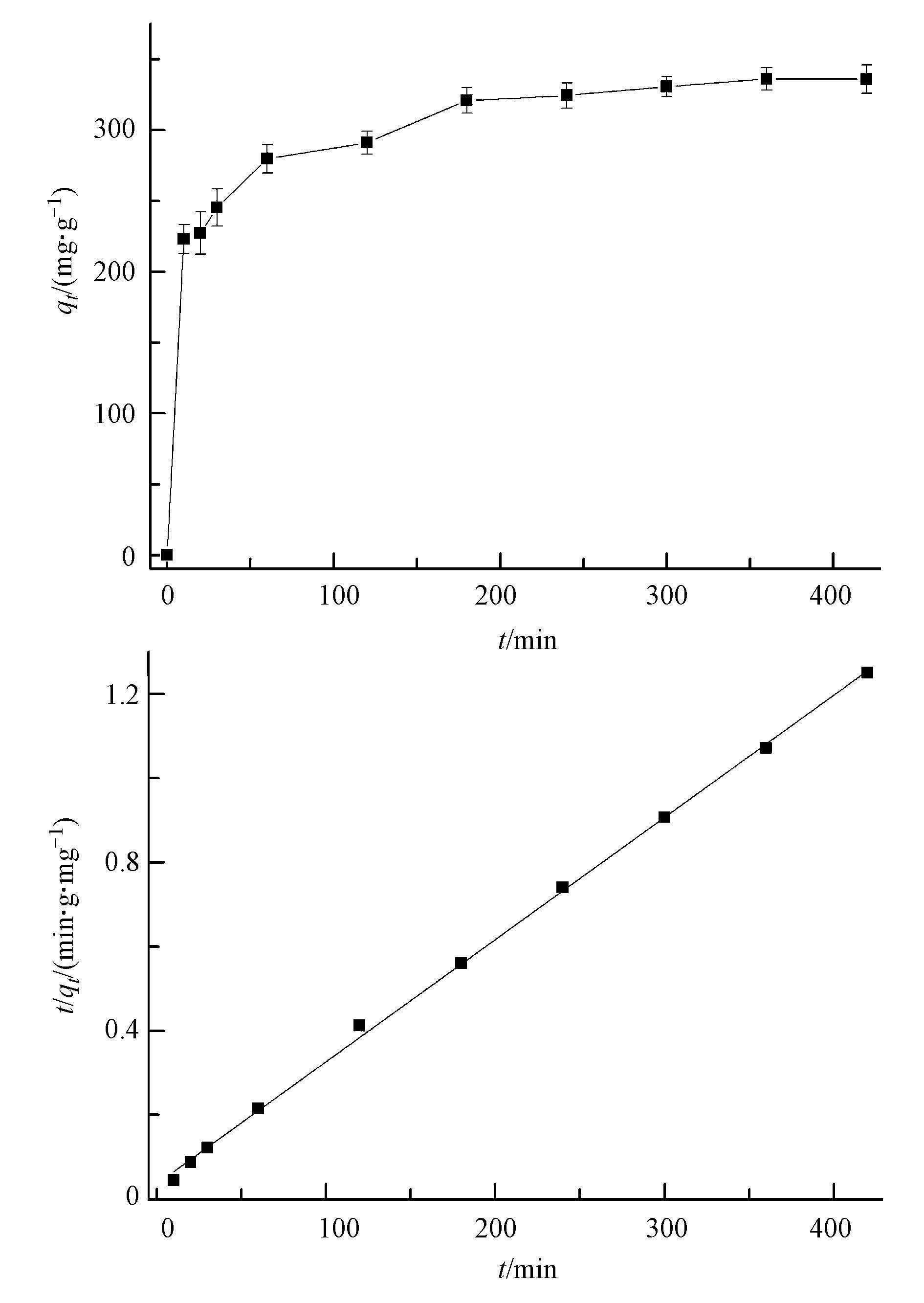
图 8甲基绿在Fe3O4@C上(a)吸附量随时间的变化及(b)拟二级动力学拟合曲线

(3) 式中,k是吸附速率常数(g·mg-1·min-1),qt是任意时刻甲基绿的吸附量(mg·g-1),qe是平衡吸附量.起始吸附速率h(mg·g-1·min-1)可以用以下方程式描述:
(4) 吸附拟二级动力学拟合如图 8b所示,线性良好,可决系数R2在0.999以上.k和h可以通过实验数据,t/qt对t作图的直线斜率和截距确定.吸附数据线性拟合的可决系数R2大于0.998,符合拟二级动力学模型.由图中斜率和截距所推算出的速率常数k和起始吸附速率h列于表 3.

表 3 Fe3O4@C对甲基绿的吸附拟二级动力学数据 3.5 吸附热力学研究 甲基绿的初始浓度设定为100 mg·L-1,吸附剂的浓度为0.2 g·L-1,改变吸附温度为20、30和40 ℃,吸附时间设定为6 h使其达到充分平衡,测定上清液中剩余甲基绿的浓度Ce,计算吸附容量qe,不同温度下的吸附数据如表 4所示.热力学参数参照文献(Biswas et al,2007)的热力学方程进行计算:
(5)
(6) 合并公式(5)和(6),得公式(7):

(7) 式(7)中,Kc为温度T下的平衡常数,可以通过Kc=qe/Ce计算,qe为平衡吸附容量,Ce为溶液中吸附质的平衡浓度,ΔGθ、ΔHθ和ΔSθ分别为标准状态下吸附反应的吉布斯自由能变、焓变和熵变.公式(7)也可以表示为:
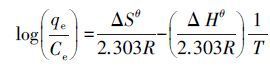
(8) 设定ΔHθ和ΔSθ在研究的温度范围内为常数,则在公式(8)中,以(qe/Ce)对(1/T)进行线性拟合,由斜率和截距可以求得ΔHθ和ΔSθ,则不同温度下的ΔGθ可由公式(5)求得,各热力学参数见表 4.
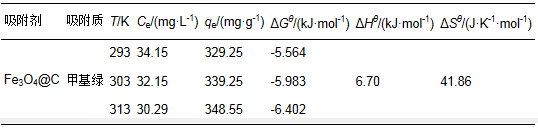
表 4 不同温度下的平衡浓度、吸附容量及热力学参数表 由表 4的热力学参数值可以看出,ΔGθ小于零,说明吸附是一个自发的过程,并且随温度升高ΔGθ减小,说明温度越高,自发性越强;ΔHθ是大于零的数,说明该吸附是吸热过程;ΔSθ大于零说明该吸附是一个熵增加的过程.具体参见污水宝商城资料或http://www.dowater.com更多相关技术文档。 4 结论(Conclusions) 采用水热合成法制备Fe3O4纳米粒子,包覆一层聚合多巴胺,然后碳化制备Fe3O4@C复合材料,将其作为吸附材料来去除甲基绿染料.在溶液pH为中性和弱碱性条件下材料对甲基绿具有较好的吸附效果.吸附动力学数据和吸附等温数据分别符合拟二级动力学模型和朗格缪尔等温吸附模型,具有较高的吸附容量.Fe3O4@C复合材料具有碳材料稳定的化学性质和优良的吸附性能,能利用磁场实现快速分离,在环境化学、分析化学以及生物化学等领域具有一定的应用潜力. 中天恒远厂家直销!优惠的价格!周到的服务! 水处理产品咨询热线:010-8022-5898 186-1009-4262 (责任编辑:李德馨) |