染料废水脱色方法
今天为大家介绍的是——染料废水脱色方法,希望对大家有所帮助。 1 引言(Introduction) 随着经济的快速发展,我国已成为染料生产大国,但随之而来产生了大量的染料废水.除了大量残留的染料外,染料废水中还含有其他有毒有害成分,如重金属离子.因此,染料废水具有成分复杂、色度、浓度高、难生物降解、水量水质变化大等特点,成为较难处理的工业废水之一。 孔雀绿是常见的三苯基甲烷类染料之一,常作为丝织品、毛织品、棉布等的染色剂.虽然孔雀绿具有高毒性、致突变性和较强的生物毒性等特性,但因其成本低廉、杀菌效果显著,因此,目前仍被广泛应用在纺织和水产养殖业.重金属通常应用于纺织染料工业的不同生产过程中,因此,染料废水中存在各种不同浓度的重金属,其中,Cr(Ⅵ)的含量比较高,而Cu(Ⅱ)次之.研究发现,极少量的重金属离子就能产生明显的中毒反应,且通过食物链被较高级的生物成倍地富集在体内,且会使生物体内的酶、蛋白质等失活,同时它无法被微生物降解,比较终累积在器官中,严重损害着人体健康和生态环境。染料废水中残留染料与重金属离子经常并存,这种复合污染具有更高的生物、细胞毒性。 染料脱色一般分为物理化学法和生物法,物化法使用方便、见效快,但成本高、二次污染严重;生物法运行费用低,处理效果显著且不会造成二次污染,是环境友好的处理方法,因而受到广泛关注。但重金属通过影响微生物体内酶的生成或酶的活性抑制微生物对染料的降解。因此,如何提高染料与重金属构成的复合污染中染料的生物降解效率成为该类废水处理的难点之一. EDTA(乙二胺四乙酸二钠)是一种常见的鳌合剂,生成的络合物在中性或碱性条件下稳定系数非常大.在一般情况下,这些螯合物的配合比都是1:1(鞠峰等, 2011).EDTA与配位离子形成环状结构,金属离子取代配位原子上的氢而进入鳌合环中,使金属离子钝化,降低其毒害作用。但目前关于采用环境中广泛存在的螯合剂减少与染料共存的重金属离子的毒性,提高染料降解效率的研究少有报道.根据之前的研究发现,某些微生物可能会将Cr(Ⅵ)还原成Cr(Ⅲ),因此,本研究拟采用EDTA降低Cr(Ⅵ)的毒性,从而提高Cr(Ⅵ)共存时微生物降解孔雀绿的效率.采用筛选出的高效好氧菌Burkholderia cepacia C09G降解孔雀绿,研究EDTA对重金属共存时降解孔雀绿的影响,同时优化EDTA鳌合Cr(Ⅵ)的比较佳浓度.通过此研究以提高在重金属共存时染料的去除效率,为复杂废水的治理奠定一定的理论基础. 2 材料与方法(Materials and methods)2.1 试剂与仪器 试剂:葡萄糖、KH2PO4、Na2HPO4·2H2O、MgSO4、FeCl3·6H2O、KNO3、孔雀绿(MG)、K2CrO7、EDTA等均为分析纯. 仪器:SKY-2102型立式双层恒温培养摇床、SPX-2508-Z型生化培养箱、722N型可见光光度计、PHS-3C型精密pH计、AA-240型原子吸收光谱仪. 2.2 试验菌种与培养基 本试验所用菌种为Burkholderia cepacia C09G(B. Cepacia C09G).LB培养基:牛肉膏5 g·L-1,蛋白胨10 g·L-1,NaCl 10 g·L-1,分装在100 mL的三角烧瓶中,每瓶装量为30.0 mL,121 ℃灭菌15 min.降解培养基:葡萄糖6.0 g·L-1,KH2PO4 1.8 g·L-1,Na2HPO4·12H2O 3.5 g·L-1,FeCl3·6H2O 0.01 g·L-1,MgSO4 0.1 g·L-1,KNO3 3.5 g·L-1,调节至pH 6.0,分装于250 mL的三角烧瓶中,121 ℃灭菌15 min. 2.3 试验方法2.3.1 菌液的制备 将菌株B. Cepacia C09G接种到灭菌后的LB培养基中,于30 ℃、150 r·min-1的恒温振荡培养箱中培养至对数期,并将所得菌液转移至50.0 mL离心管中,7000 r·min-1离心10 min,弃除上清液,用无菌水稀释成菌悬液,4 ℃保存备用. 2.3.2 MG和Cr(Ⅵ)去除试验 将已算好体积的药品加入降解培养基中,每支玻璃离心管(无菌)中加入15.0 mL的降解培养液,再加入菌液(初始OD600=0.7,体积比6%),塞上棉花塞,放入摇床(150 r·min-1,30 ℃)培养0、12、24、36、48、60 h后分别测定OD600、MG和Cr(Ⅵ)浓度.上述每个试验均做3个平行,结果取其平均值,并计算标准偏差. 2.4 生物量、MG及Cr(Ⅵ)的测定 从恒温摇床中取出各时段的降解培养基,在比较大吸收波长600 nm处用可见分光光度计测其吸光度,以波长600 nm处的光密度OD600表示细菌生长量. 取上清液,孔雀绿(MG)采用分光光度计测定619 nm处比较大吸收峰的吸光度值,以A619表示;利用原子吸收光谱仪测定溶液剩余Cr(Ⅵ)浓度.去除率R计算公式如下:
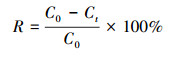
(1) 式中,C0表示初始时MG或Cr(Ⅵ)的浓度(mg·L-1);Ct表示t时MG或Cr(Ⅵ)的浓度(mg·L-1). 2.5 表征 扫描电子显微镜(SEM)观察:采用JSM-7500型扫描电子显微镜观察样品的表面形貌和微观形态;X射线能量色散谱(EDS)分析:利用与SEM联机的X射线能量散射仪分析样品表面的元素种类和含量;傅里叶变换红外光谱(FTIR)分析:采用Thermo Nicolet 5700红外光谱仪,获取试样的FTIR谱图,溴化钾压片,扫描范围为4000~400 cm-1;X射线光电子能谱(XPS)分析:采用VG ESCALAB 250型X射线光电子能谱仪对吸附孔雀绿和Cr(Ⅵ)后的Burkholderia cepacia C09G进行分析. 3 结果与讨论(Results and discussion)3.1 不同条件对孔雀绿降解过程的影响 所有实验均用Burkholderia cepacia C09G降解0.1 mmol·L-1孔雀绿,仅加入孔雀绿的为空白实验,其他实验再分别加入0.5 mmol·L-1 Cr(Ⅵ)、0.5 mmol·L-1 EDTA,以及同时加入0.5 mmol·L-1 Cr(Ⅵ)和0.5 mmol·L-1 EDTA,放入摇床中好氧培养0、12、24、36、48、60 h后取出测定OD600、A619、Cr浓度. 3.1.1 OD600 如图 1所示,在空白实验中(没有重金属Cr(Ⅵ)或者EDTA存在的条件下),即仅加入0.1 mmol·L-1的孔雀绿(MG)时,B. Cepacia C09G在前36 h快速生长,OD600接近了0.7,而后因为MG基本降解完,缺乏营养物质生物量增长缓慢,60 h后比较终OD600值为0.78;仅加入0.5 mmol·L-1 Cr(Ⅵ),对微生物的生长有很强的抑制作用,生物量很低,仅为0.15;仅加入0.5 mmol·L-1 EDTA,毒性虽然比Cr(Ⅵ)更小,但仍有一定的抑制作用,60 h时OD600为0.31.据报道,EDTA和EDTA-Metal对土壤微生物都是有毒的(Grcman et al., 2001).当同时添了EDTA和Cr(Ⅵ)时,OD600为0.42,大于单独加入Cr(Ⅵ)或者EDTA时,说明其生物毒性比单独加入Cr(Ⅵ)或EDTA有所降低,因此,可以推测EDTA可以有效降低Cr(Ⅵ)的毒性.
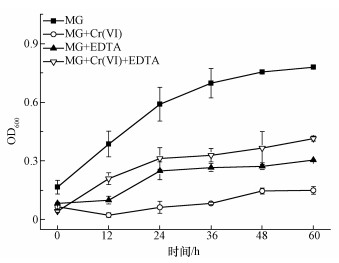
图 1不同条件下孔雀绿(MG)的OD600值 3.1.2 孔雀绿(MG)去除率 图 2a为不同条件对孔雀绿的降解影响,在仅加入0.1 mmol·L-1 MG的情况下,MG在24 h的去除率达到96.2%;只添加0.5 mmol·L-1 Cr(Ⅵ),60 h时MG的去除率均为6.7%,单独添加0.5 mmol·L-1 EDTA时,60 h时MG的去除率为48.4%,说明Cr(Ⅵ)和EDTA均会抑制B. Cepacia C09G对孔雀绿的降解.同时添加EDTA和Cr(Ⅵ)时,60 h MG的去除率上升到18.8%,相对于单独加Cr(Ⅵ)的降解率有所提高,可以看出,EDTA确实可以有效地降低Cr(Ⅵ)的抑制作用,从而提高对孔雀绿的降解效率.也有研究证实,加入EDTA可以降低5 μmol·L-1 Cd、Cu和Zn对细菌Escherichia coli的毒性(Campbell et al., 2000).
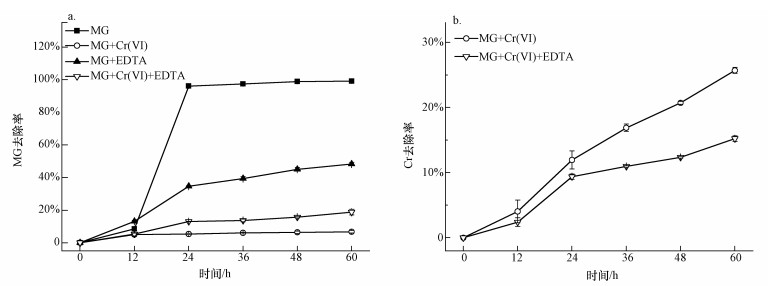
图 2不同条件下孔雀绿降解率(a)和Cr去除率(b) 3.1.3 Cr去除率 图 2b为离心后的降解培养基中总Cr浓度,可能是由于EDTA可以有效螯合Cr,因此,减少了B. Cepacia C09G吸附Cr的效率,去除率从25.7%降低到15.2%. 3.2 0.5 mmol·L-1 EDTA螯合的比较佳Cr浓度 将菌株C09G加入初始Cr(Ⅵ)浓度分别为0.5、0.6、0.7、0.8、0.9 mmol·L-1,EDTA浓度为0.5 mmol·L-1,MG浓度为0.1 mmol·L-1的降解培养基中,放入摇床中好氧培养0、12、24、36、48、60 h后取出测定OD600、A619、Cr的浓度. 3.2.1 OD600 如图 3a所示,随着加入Cr(Ⅵ)浓度的升高,生物量OD600先升高后降低,加入Cr(Ⅵ)浓度为0.7 mmol·L-1时达到比较高.在加入的Cr(Ⅵ)浓度分别为0.5、0.6、0.7、0.8、0.9 mmol·L-1时,60 h时OD600分别为0.45、0.55、0.72、0.62、0.43,微生物生长良好,因此,EDTA可适度地降低Cr的毒性.但总的来说,Cr单独存在,或者与EDTA形成螯合物,对微生物都是有毒的,因而生物量都偏低.
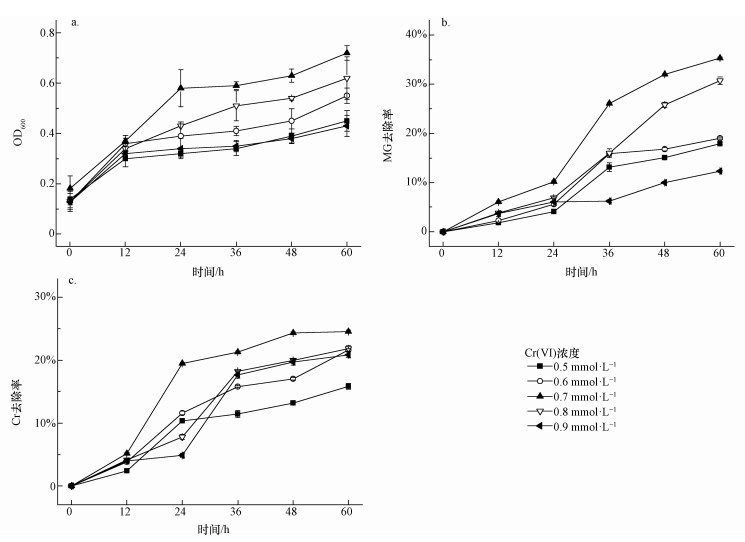
图 3不同初始Cr(Ⅵ)浓度下OD600值(a)、孔雀绿降解率(b)和Cr去除率(c) 3.2.2 孔雀绿(MG)去除率 由图 3b可知,除Cr(Ⅵ)浓度为0.7、0.8 mmol·L-1外,其余Cr(Ⅵ)浓度条件下的MG降解并不理想,均小于20%;而Cr(Ⅵ)初始浓度为0.7 mmol·L-1时,MG的去除率为35.3%,当浓度增加到0.8 mmol·L-1时,MG的降解率下降到了30.7%.因此,确定0.5 mmol·L-1 EDTA存在下,螯合的比较佳Cr(Ⅵ)浓度为0.7 mmol·L-1. EDTA和重金属的螯合比例一般为1:1(鞠峰等, 2011),Cr(Ⅵ)以阴离子存在,不能和EDTA螯合,但根据报道,Cr(Ⅵ)会被微生物还原成Cr(Ⅲ)(甘莉等, 2014).因此推测,部分Cr(Ⅵ)会被微生物还原成Cr(Ⅲ),被还原的Cr(Ⅲ)跟EDTA螯合,减少了毒性.EDTA或者Cr(Ⅵ)过量,MG去除率都会降低. 3.2.3 Cr去除率 如图 3c所示,Cr(Ⅵ)初始浓度分别为0.5、0.6、0.7、0.8、0.9 mmol·L-1时,总Cr的去除率分别为15.8%、21.6%、24.6%、21.8%、20.9%.Cr去除率随着加入的Cr(Ⅵ)浓度增加而增加,当Cr(Ⅵ)为0.7 mmol·L-1时Cr去除率比较高,之后开始下降,但降低幅度很小.可能是因为高浓度的Cr传质效果更好,因而更易于被微生物富集.相对于无EDTA存在情况下,B. Cepacia C09G对Cr吸附率略有下降,但在比较佳的螯合浓度下,由于减少了Cr的毒性,增加了生物量,使得吸附率有所提高.但总的来说,在EDTA存在条件下,B. Cepacia C09G对Cr吸附能力均较低. 3.3 降解过程的表征3.3.1 XPS 为了检测Cr(Ⅵ)价态变化,采用X射线光电子能谱(XPS)分析吸附孔雀绿和Cr(Ⅵ)后的Burkholderia cepacia C09G,图 4是菌体表面Cr的2p轨道核心区域的XPS光谱图及其拟合曲线.可以看出,Cr2p1/2的结合能在584.0 eV处,而Cr2p3/2的结合能在577.4 eV处,可知两个能值与Cr(Ⅲ)的结合能相对应,这说明在菌体表面应该存在Cr(Ⅲ),而吸附前,培养基中只有Cr(Ⅵ),因此,推测培养基中Cr(Ⅵ)在Burkholderia cepacia C09G的作用下被吸附到其表面后,利用菌体内的还原酶,Cr(Ⅵ)被还原为Cr(Ⅲ).其他文献也有类似报道,细菌可利用细胞NADH作为还原剂,在好氧或厌氧状态下,将高毒性的Cr(Ⅵ)直接还原成低毒的Cr(Ⅲ)(Lira-Silva et al., 2011),如利用Burkholderia vietnamiensis C09V同时去除结晶紫和Cr(Ⅵ)时,该菌在降解结晶紫的同时将Cr(Ⅵ)还原成Cr(Ⅲ)(甘莉等, 2014).
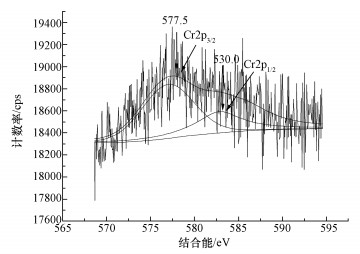
图 4吸附后Burkholderia cepacia C09G的Cr2p能谱图 3.3.2 SEM 由图 5a可知,当溶液中只有孔雀绿存在时,B. Cepacia C09G细胞形态几乎没有破损,细胞表面完整圆滑饱满、生长良好.当孔雀绿溶液中加入0.5 mmol·L-1 EDTA时,细胞形态有些略微的损伤(图 5b).当加入Cr(Ⅵ)后,微生物细胞表面严重受损,细胞表面凹凸不平且变得干瘪(图 5c).如图 5d所示,同时加入0.5 mmol·L-1 EDTA和0.5 mmol·L-1 Cr(Ⅵ)后,与只加EDTA相比,对细胞形态影响相对较小,与不加EDTA与Cr(Ⅵ)的细胞形态相比虽然能维持较完整的细胞形态,还是有略微损伤.从图 5中可以看出,EDTA与Cr(Ⅵ)都能破坏细胞的结构,从而降低微生物的活性,同时加入EDTA和Cr(Ⅵ)后,EDTA减少了Cr(Ⅵ)对B. Cepacia C09G的毒性.

图 5降解后Burkholderia cepacia的SEM图(10000×)(a.0.1 mmol·L-1 MG, b. 0.1 mmol·L-1 MG+0.5 mmol·L-1 EDTA, c. 0.1 mmol·L-1 MG+0.5 mmol·L-1 Cr(Ⅵ), d.0.1 mmol·L-1 MG+0.5 mmol·L-1 EDTA+0.5 mmol·L-1 Cr(Ⅵ)) 3.3.3 EDS 通过EDS确定菌株B. Cepacia C09G生物吸附MG、Cr(Ⅵ)或者EDTA后菌株局部所含元素,从图 6中可以看出,图中均含有C、K、O、Na、P,这些元素主要是来自于微生物自身;此外,图 6b和6c中还含有Cr,这表明菌株有效地吸附了Cr,来源于溶液中加入的K2Cr2O7.图 6b和6c中分别在0.48、5.40和5.96 keV处出现峰,显示存在Cr元素,这就证明了C09G菌在去除孔雀绿的同时也可以吸附Cr.而且在图 6c与6b的对比中可以看出,当加入了EDTA后,Cr的含量明显减少,从0.59%降低到0.37%,说明EDTA相比于菌株对Cr的亲和力更强.
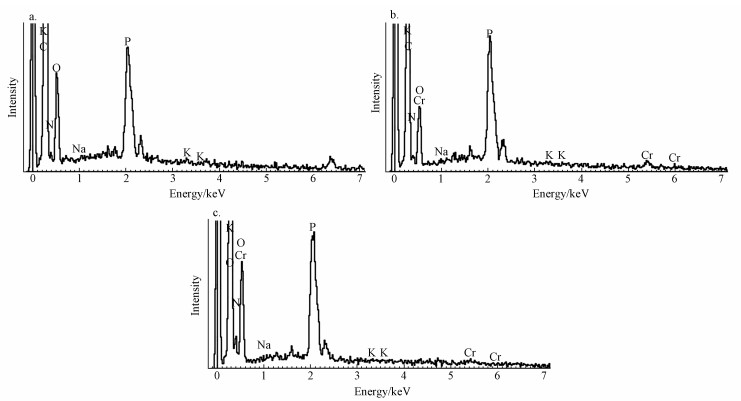
图 6降解后Burkholderia cepacia的EDS图(a. 0.1 mmol·L-1 MG, b. 0.1 mmol·L-1 MG+0.5 mmol·L-1Cr(Ⅵ), c.0.1 mmol·L-1 MG+0.5 mmol·L-1 EDTA+0.5 mmol·L-1 Cr(Ⅵ)) 3.3.4 FTIR 图 7为菌株B. Cepacia C09G吸附孔雀绿及孔雀绿和Cr(Ⅵ)后的FTIR光谱图.由图 7可知,2939~2927 cm-1处的峰是—CH、—CH2及—CH3的不对称振动峰,在1655 cm-1和1546 cm-1处出现由氨基酸I的—NH2与氨基酸II的—COOH形成的—NH/CO的伸缩振动吸收峰,1408~1405 cm-1处分别为孔雀绿及降解产物芳环上的C=C的伸缩振动峰和O—H的弯曲振动峰.图 7b相比于图 7a,在2452 cm-1和845 cm-1处的峰消失,1070 cm-1处峰的产生是由于氨基酸的—NH转变为C=N共轭键.这说明菌株C09G的去除过程主要是—OH、—COOH、—NH2、—NH/CO等官能团与Cr相互作用(Nandi et al., 2009).
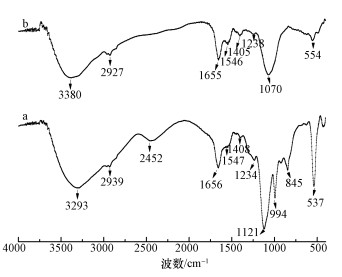
图 7菌株B. Cepacia C09G吸附孔雀绿(a)及孔雀绿和Cr(Ⅵ) (b)后的FTIR光谱图 4 结论(Conclusions) 1) 0.1 mmol·L-1孔雀绿单独存在条件下,24 h的生物降解率达到96.2%;然而,在0.5 mmol·L-1 Cr(Ⅵ)共存时,60 h的降解率仅为6.7%;当加入0.5 mmol·L-1 EDTA螯合剂后,60 h时孔雀绿的降解率提高到18.8%.说明Cr(Ⅵ)、EDTA都会抑制孔雀绿的降解,加入0.5 mmol·L-1 EDTA螯合Cr后,可显著降低Cr的毒性.具体联系污水宝或参见http://www.dowater.com更多相关技术文档。 2) 对于0.5 mmol·L-1 EDTA,比较佳螯合Cr(Ⅵ)的浓度为0.7 mmol·L-1,此时,60 h的孔雀绿降解率上升到35.3%,Cr吸附率为24.6%,生物量也有所提高. 3) XPS表征证明,Burkholderia cepacia C09G可将Cr(Ⅵ)还原为Cr(Ⅲ);从SEM图谱可知,加入EDTA后,降低了Cr对B. Cepacia C09G的毒性;EDS证实加入EDTA后,降低了B. Cepacia C09G对Cr的吸附效率;FTIR说明,菌株C09V的去除过程主要是—OH、—COOH、—NH2、—NH/CO等官能团与Cr相互作用.

污水处理设备联系方式: 销售热线:010-8022-5898 手机号码:186-1009-4262 (责任编辑:李德馨) |